Antes de conocer lo que es calorimetría debemos recordar algunos conceptos básicos.
¿Qué es Calor?
Definimos calor como la Energía Térmica que se transfiere de un objeto a otro cuando entran en contacto mutuo, debido a una diferencia de temperaturas entre ellos.
La dirección de la trnasferencia de dicha energía siempre dependerá de la cantidad de temperatura que contenga la sustancia, es decir, se dirigirá desde la sustancia de mayor temperatura hacia la de menor temperatura (o sea desde la más caliente a la más fría).
Cuando fluye calor entre dos objetos o sustancias que se encuentran unidas; se dice que están en CONTACTO TÉRMICO.
Esquema del contacto térmico entre dos objetos
Mientras
no hallan otros factores externos (el sistema sea cerrado) el calor
perdido por el cuerpo A es igual al calor ganado en el cuerpo B.
Cuando dos objetos se encuentran en contacto térmico, la temperatura del más caliente disminuye y la del más frío aumenta, hasta llegar ambos a la misma temperatura, es decir, quedan en EQUILIBRIO TÉRMICO.
Propagación del Calor
Para transmitir el calor de un lugar a otro, solo se puede realizar de estas tres formas:
Conducción.
Transferencia de calor a través de un cuerpo o entre dos cuerpos en contacto, sin que se desplacen las moléculas de los mismos. Ocurre sólo en los materiales sólidos. Ejemplo: Una barra de metal cuyo extremo se lo acerca a una llama, permite que fluya calor hasta su extremo opuesto.
El desplazamiento de calor se realiza según la facilidad con lo que permita el material, de lo cual surge el concepto de Conductividad Térmica.
Convección.
Transferencia de calor entre dos partes de un cuerpo a causa del desplazamiento de sus moléculas. Ocurre sólo en los fluídos (líquidos y gases). El movimiento de las moléculas se origina por la diferencia de densidades que hay dentro de la sustancia, generando corrientes de convección desde las partes más calientes hacia las más frías en la masa del fluído. Ejemplo: Cuando se calienta un recipiente con agua, las moléculas del líquido que están en contacto con la zona caliente (llama) se mueven hacia la superficie donde se encuentran con el resto de moléculas más frías, haciendo que a su vez estas moléculas frías se desplacen hasta la zona de calor y comiencen el ciclo nuevamente. Este proceso dentro del líquido hace que el agua adquiera calor repetidamente, hasta alcanzar la temperatura suficiente de ebullición.
Conducción.
Transferencia de calor a través de un cuerpo o entre dos cuerpos en contacto, sin que se desplacen las moléculas de los mismos. Ocurre sólo en los materiales sólidos. Ejemplo: Una barra de metal cuyo extremo se lo acerca a una llama, permite que fluya calor hasta su extremo opuesto.
El desplazamiento de calor se realiza según la facilidad con lo que permita el material, de lo cual surge el concepto de Conductividad Térmica.
Convección.
Transferencia de calor entre dos partes de un cuerpo a causa del desplazamiento de sus moléculas. Ocurre sólo en los fluídos (líquidos y gases). El movimiento de las moléculas se origina por la diferencia de densidades que hay dentro de la sustancia, generando corrientes de convección desde las partes más calientes hacia las más frías en la masa del fluído. Ejemplo: Cuando se calienta un recipiente con agua, las moléculas del líquido que están en contacto con la zona caliente (llama) se mueven hacia la superficie donde se encuentran con el resto de moléculas más frías, haciendo que a su vez estas moléculas frías se desplacen hasta la zona de calor y comiencen el ciclo nuevamente. Este proceso dentro del líquido hace que el agua adquiera calor repetidamente, hasta alcanzar la temperatura suficiente de ebullición.
Radiación.
Transferencia de calor y energía de un cuerpo llamado foco a otro cuerpo distante, a través del VACÍO,
es decir, sin la presencia de algún agente material o sustancia
intermedia. Esta transferencia se logra gracias a que la energía se
transporta por medio de Ondas Electromagnéticas las cuales pueden propagarse por el vacío sin ningún inconveniente. Ejemplo: Una bombilla emite luz y calor en forma de radiación. Esta radiación corresponde a: Ondas de Luz Visible (que nos permiten ver) y a las ondas infrarrojas (que nos dan la sensación de calor).
Otras fuentes de luz como el Sol, aparte de las anteriores, también
emite rayos X, microondas, ultravioleta, etc., las cuales no somos
capaces de sentir, pero que sí lo pueden hacer aparatos e instrumentos
apropiados.
El Calor Específico
El calor específico es la cantidad de calor que se necesita por unidad de masa para elevar la temperatura un grado Celsio. La relación entre calor y cambio de temperatura, se expresa normalmente en la forma que se muestra abajo, donde c es el calor específico. Esta fórmula no se aplica si se produce un cambio de fase, porque el calor añadido o sustraido durante el cambio de fase no cambia la temperatura.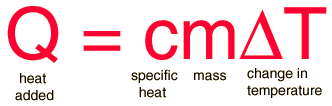
El calor específico del agua es 1 caloría/gramo °C = 4,186 julios/gramo °C que es mas alto que el de cualquier otra sustancia común. Por ello, el agua desempeña un papel muy importante en la regulación de la temperatura. El calor específico por gramo de agua es mucho mas alto que el de un metal, como se describe en el ejemplo de agua-metal. En la mayoría de los casos es mas significativo comparar los calores específicos molares de las sustancias.
De acuerdo con la ley de Dulong y Petit, el calor específico molar de la mayor parte de los sólidos, a temperatura ambiente y por encima, es casi constante. A mas baja temperatura, los calores específicos caen a medida que los procesos cuánticos se hacen significativos. El comportamiento a baja temperatura se describe por el modelo Einstein-Debye para el calor específico.
Tabla de valores de calores específicos
Cp
|
Cv
|
|
Aire.
|
0.237
|
0.169
|
Oxigeno.
|
0.217
|
0.157
|
Nitrógeno.
|
0.244
|
0.172
|
¿Qué es Calorimetría?
Definimos a la Calorimetría como la medida de la cantidad de calor que cede o absorbe un cuerpo en el curso de un proceso físico o químico.
Esquema de experimento con calor
Por ello diremos:
El calor es lo que absorbe (o cede) un cuerpo para aumentar (o disminuir) su temperatura.
El Calorímetro
Los calorímetros son aparatos que establecen la cantidad de calor que absorbe o cede un cuerpo al variar su temperatura.
Estos dispositivos pueden ser tan simples o tan complejos, aquí veremos algunos de ellos:
Estos dispositivos pueden ser tan simples o tan complejos, aquí veremos algunos de ellos:
- Calorímetro de presión constante: En un calorímetro de presión constante, la reacción se lleva a cabo en una solución en la cual la presión atmosférica es constante. El calorímetro mide el cambio en la entalpía, que es una medida del calor total contenido por un sistema. Los calorímetros de presión constante son sencillos de construir, y son los que se utilizan en el aula.
Esquema de calorímetro de presión constante
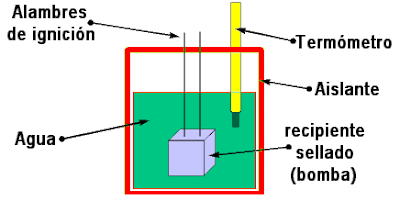
- Bomba o calorímetro de volumen constante: La bomba, o calorímetro de volumen constante, se usa para medir cosas como una reacción de combustión. Esta información es útil para determinar la cantidad de calor (calorías) en alimentos y combustibles. Se crea una reacción en una cámara diseñada para soportar altas temperaturas y explosiones. La cámara está rodeada por una camisa de agua que se calienta con la energía proveniente de la reacción. Luego de finalizada la reacción, los científicos miden la temperatura del agua para determinar la cantidad de energía liberada.
Esquema de calorímetro de volumen constante
- Otros calorímetros: Las variaciones de estos tipos de calorímetros básicos existen, incluyendo el calorímetro tipo Calvet, el calorímetro adiabático y de reacción, entre otros. Los calorímetros tipo Calvet se basan en un sensor tridimensional de flujo para detectar la transmisión de calor. Los calorímetros adiabáticos miden las reacciones a calor constante, aquellas que producen en un proceso adiabático, un término de la termodinámica. Como los calorímetros bomba, los calorímetros de reacción trabajan creando una reacción en un recipiente cerrado y midiendo el efecto sobre el calor.
Esquema de un calorímetro semiadiabática
Determinacióm del Calor específico de una Sustancia
Con el calorímetro de las mezclas se procede
así:
1. Se coloca en el vaso una cantidad conocida de agua. El
termómetro indicara su temperatura, por ejemplo: 15°C
2. Se introduce luego un cuerpo cualquiera de masa m, conocida, y que esta a una temperatura dada, por ejemplo: 100°C.
3. Tapamos perfectamente los dos vasos, y con el agitador tratamos de que toda la masa de agua alcance una temperatura uniforme.
4. Durante el proceso de agitad estaremos observando detenidamente el termómetro. La columna mercurial comienza a ascender, pues el cuerpo a 100°C cede calor al agua y la calienta.
5. Llegará un momento en que el termómetro no ascienda. En ese instante anotamos la temperatura que es la llamada temperatura final, por ejemplo: 47°C
Gracias por ver nuestro Blog sobre la calorimetría, espero que les sirva de mucha ayuda.
Grupo: M-04 Nivelación Carrera de Medicina
Tema: Calorimetría
Integrantes:
Victoria Albán
Joselyn Cueva
Elvis Mendoza
Steven Granja
Jennifer Luzón
Jenny Ayala
Susana Morán
Katherine Pinto
Walter Granda
"Nunca consideres el estudio como una obligación, sino como una oportunidad para penetrar en el bello y maravilloso mundo del saber." - Albert Einstein (1879-1955) Científico alemán nacionalizado estadounidense.










No hay comentarios:
Publicar un comentario